请问两电极体系施加一个恒定电压,两个电极的电势如何发生变化?
电化学体系中,判断一个反应发生与否,往往是根据溶液半反应的能斯特电位和电极电势做对比判断的。但实验过程中通常是控制两个电极之间的电压大小,就很想了解一个恒定电压施加在两个电极上,两个电极上的电势是如何分配的?
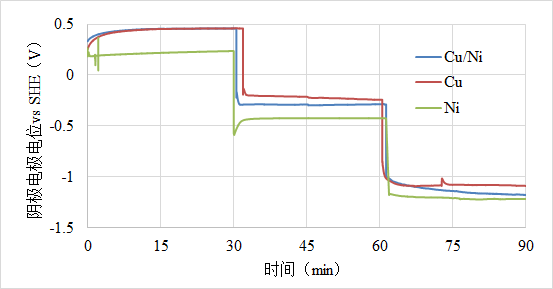
电解质溶液是硝酸铜和硝酸镍,阴极是不锈钢电极,阳极是钛钌网电极,在30,60,90min时候分别加1,2,3V的电压,其中不锈钢电极的电势是这样变化的,这样的结果怎么分析?想问问电极电势的变化是由什么因素决定的?
微信图片_20200721145511.png@VIMPILE@langzhizhou@louderbe@a88592718@Gamry-电化学![]() 返回小木虫查看更多
返回小木虫查看更多
今日热帖



 京公网安备 11010802022153号
京公网安备 11010802022153号
1
2
要知道工作电极上的电位变化,必须使用三电极体系,即还需要一个参考电极。你能控制的恒电位只能是工作电极相对于参考电极的电位,而不是工作电极相对于对电极。
两电极体系是不能确定某一时刻外加在某一电极上的电位数值的,即使你认为施加的是恒电位,因你的恒电位是加在两个电极上的电压差,当对电极表面有电流通过时,其表面性质发生了变化,电位也会变化,实际上,这时两个电极的电位都在变化。
图中可以看到随着施加电位的增大,阴极的电位越来越负,这是受电化学极化的影响(反应物浓度足够)。随着电极电位的变化,需要在电极表面建立新的平衡状态,伴随着电极电势的改变。当施加电压增大时,相应的电极表面的反应速度加快,反应物浓度足够时,阴极表面会有电子的累积,限制反应速度,导致电极电位越来越负。
谢谢您的回复,请问您说的“反应物浓度足够时,阴极表面会有电子的累积,限制反应速度,导致电极电位越来越负”,这句话中“阴极表面会有电子的累积”是什么意思呢,请问为什么会在阴极表面有电子的累积。
换句话说,假设电解质是纯水或者浓度极低的Cu(II)离子溶液,当电压从2V突然增大到3V时,电极电势会有怎样的变化呢
,