请问两电极体系施加一个恒定电压,两个电极的电势如何发生变化?
电化学体系中,判断一个反应发生与否,往往是根据溶液半反应的能斯特电位和电极电势做对比判断的。但实验过程中通常是控制两个电极之间的电压大小,就很想了解一个恒定电压施加在两个电极上,两个电极上的电势是如何分配的?
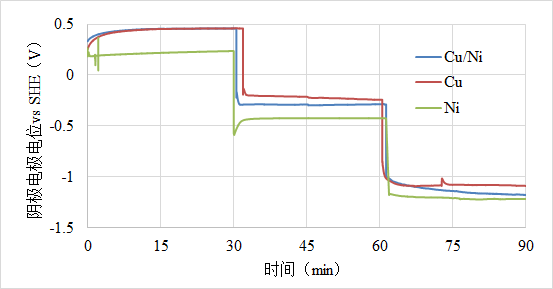
电解质溶液是硝酸铜和硝酸镍,阴极是不锈钢电极,阳极是钛钌网电极,在30,60,90min时候分别加1,2,3V的电压,其中不锈钢电极的电势是这样变化的,这样的结果怎么分析?想问问电极电势的变化是由什么因素决定的?
微信图片_20200721145511.png@VIMPILE@langzhizhou@louderbe@a88592718@Gamry-电化学![]() 返回小木虫查看更多
返回小木虫查看更多
今日热帖



 京公网安备 11010802022153号
京公网安备 11010802022153号
我的阴极电势是通过三电极体系测试的,不过实验电路是双电极体系。
①电子累积的意思是电极反应速度比较慢,有电流通过时到达阴极的电子不能被及时消耗掉,致使电极比可逆情况下带有更多的负电,从而使电极电势变得比较低。
②对于你的假设,电极电势也会变得越来越负,这时变成浓差极化主要影响电极电势,可忽略电化学极化的影响。
我对帖子中“当施加电压增大时,相应的电极表面的反应速度加快,反应物浓度足够时,阴极表面会有电子的累积,限制反应速度,导致电极电位越来越负。”也有疑惑。
1、电压增大时,电极表面反应速度加快的原因是什么?我一直以为是因为阴极表面的电子增多导致的。
2、我对这个图的理解是这样的,当电压增大的瞬间,电极表面的电子增多,表面金属离子和电子间的反应加快,从而导致表面的金属离子浓度下降,表面的电子积累,电位发生骤降。最后电极电势相对稳定的阶段是因为体系对电压的突变做的调节后的平衡状态,比如重新构建了双电层等。不知道我的这个理解有没有问题,还请老师指点一下?
3、如果我2中的理解不正确,那么请老师解释一下每个电压条件下电势平稳的那一段结果?
谢谢老师
,
①根据塔菲尔公式η=a+blgj,当电极的过电位增大,相应的电极电流密度会增大,表明电极表面反应速度加快。可以理解为电压增大时,反应的推动力会增大。
②电压增大的瞬间,电极表面的电极电势可以瞬间改变,而电流的变化不会瞬间改变,需要有电子流动的过程。
③每个电压条件下电势平稳,相当于电极表面建立了新的稳态。电压改变,电极表面会重新构建双电层,然后逐渐达到电化学反应稳定的状态。
谢谢老师解答,但还有一点疑问,原贴中“反应物浓度足够时,阴极表面会有电子的累积,限制反应速度,导致电极电位越来越负。”,如果反应物浓度足够时,阴极表面的电子不是应当被表面的反应物及时地消耗掉,怎么会有电子的积累呢?
我觉得这个电荷累积是不是就是速控步骤是电化学步骤的意思,整个过程就是传质和传荷的比较
有可能诶,可能是我基础不好,潜意识认为速控步骤是电化学步骤的意思是电极表面电荷分布少导致的,所以就以为电荷应该是那个比较稀缺的。
那你很棒哦