关于电位-pH图的求助
最近在写一篇论文,做一个电位-ph图。原料中含有CeO2,采用HCl浸出,查了反应式是:2CeO2+8HCl=2CeCl3+Cl2+4H2O。也就是说HCl起还原作用。查了相关做铈的电位-pH的文献(已有文献中没有画Cl-线),画了图(可能存在的电极反应在图左下角)。 理论上来说,要使得CeO2生成Ce3+, 则还原剂的还原电位要低于CeO2/Ce3+线(①线)。但是我发现Cl2/Cl-线(⑥线)与①线的交点在水的稳定区域之外,而且与O2线的交点为pH=-2.17,此时的酸度为10的2.17次方,只有在此交点以左,水的稳定区域以内,HCl在水溶液中的还原作用才能体现出来吧,,此时酸度更大。实际溶液中不存在这么高的酸度。从图来看HCl做还原剂岂不是不行?而实际CeO2可以被HCl还原。希望得到老师的指点。非常感谢!
图1为我自己画的电位-pH图,图2为一文献中关于Ce的电位图。
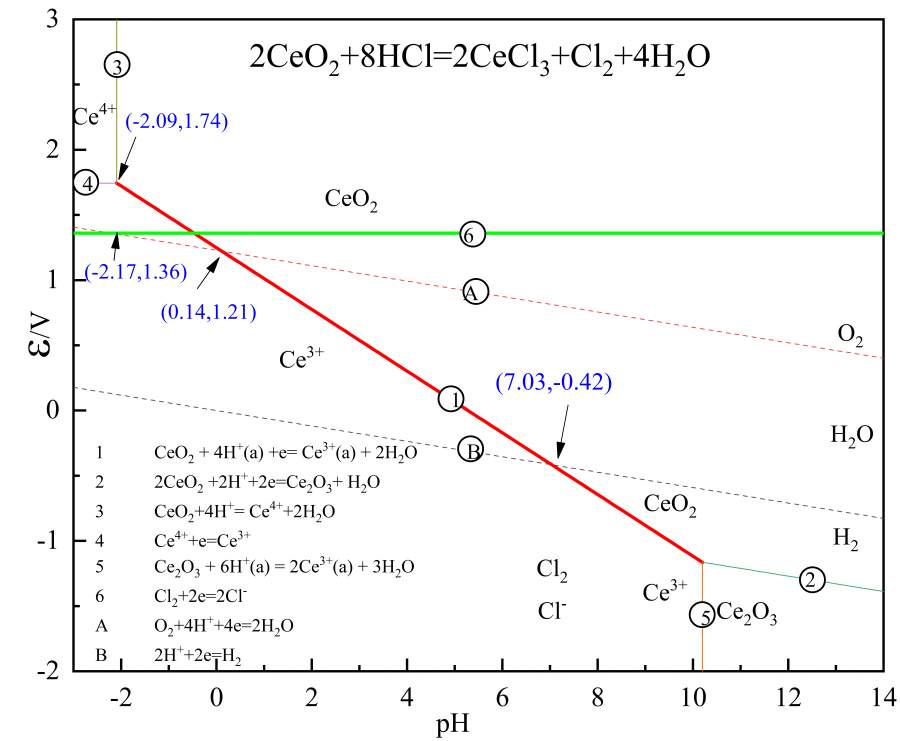
我自己画的图.jpg

文献中的图.png![]() 返回小木虫查看更多
返回小木虫查看更多
今日热帖



 京公网安备 11010802022153号
京公网安备 11010802022153号
要考虑氧化态及还原态浓度对直线位置的影响,查出来的数据一般氧化态以及还原态浓度都为1M,浓度不是1M的时候会上下平移
楼上正解,把可溶离子活度设置成0.001再绘制,你会发现1线右移6线下移。
Ce浸出率比较高,通过溶液中浓度测试有接近Ce3+=1M。HCl浓度比较大,因此,此处我再换算成Cl=8M,6线值为1.31V,下降并不明显。此时6与A线的交点为pH=-1.33,也在正常酸度之外。6与1线的交点亦在H2O稳定区域之上。
Ce浸出率比较高,通过溶液中浓度测试有接近Ce3+=1M。HCl浓度比较大,因此,此处我再换算成Cl=8M,6线值为1.31V,下降并不明显。此时6与A线的交点为pH=-1.33,也在正常酸度之外。6与1线的交点亦在H2O稳定区域之上
,