疑惑,界面化学之质子化反应的pH变化问题?
RT
大家都知道吸附剂表面在水溶液中可以羟基化,
即生成了S-OH
那么在酸性条件下可以发生如下反应
S-OH + H+ = SOH2+ (可逆反应)
好了,如果发生了这样的反应的话
那么我的水溶液中的pH值就会升高了,因为H+消耗了,对吗?
小弟最近处理数据正发现了这个问题
在pH=2-4左右情况下 吸附后的pH反而有所升高了
吸附的是Cu2+,如果这样解释的话就通了
请看下图:
不知道这样分析对不对呀?
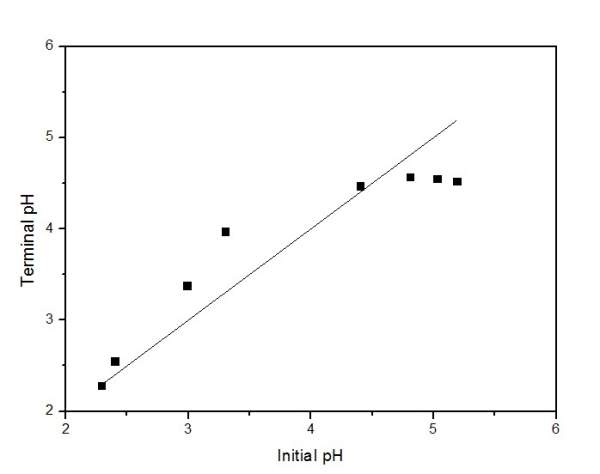
pH前后变化情况.jpg
[ 来自小组 木虫环保 ]![]() 返回小木虫查看更多
返回小木虫查看更多
今日热帖



 京公网安备 11010802022153号
京公网安备 11010802022153号
金属离子的水解,是主要因素。
这个解释是胡扯。就算吸附剂水解结合oh,那水里面还有h,不可能那部分H就消失的
吸附的铜离子多了,则释放出来的氢氧根多。
一般通过羟基作为活性点位来吸附铜离子的话,极有可能是络合吸附,当然,络合吸附又分为inner-complex和outer-complex,如果是前者的话,就伴随着羟基释放的过程,pH值就会相应升高;在酸性条件下,金属离子的水解是受到抑制的。另外,这个过程不是你描述的那么简单的,在酸性条件下,羟基是有可能质子化的,但这个质子化不足以引起溶液中pH的变化,你可以做个试验验证一下,不加铜离子,看ph是不是基本不变(排除空气中co2的影响)。另外JCIS上有较多的类似介绍络合吸附机理性的文章,多看看,有助于你解释清楚,而且你解释的时候得引用别人的文献,而不是你随便空想就行的,
师弟啊,多赏点金币!缺钱用啊!