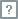| 查看: 1108 | 回复: 2 | |||
| 当前只显示满足指定条件的回帖,点击这里查看本话题的所有回帖 | |||
[交流]
新药申报流程 已有1人参与
|
|||
|
新药临床试验申请(IND) 1. 申请人完成支持药物临床试验的药学、药理毒理学等研究后,向国家药品监督管理局药品审评中心(CDE)提出药物临床试验申请,按照申报资料要求提交相关研究资料。 2. 药品审评中心对申报资料进行形式审查,符合要求的,出具受理通知书;不符合要求的,出具不予受理通知书或者申请材料补正通知书,并说明理由。 3. 药品审评中心组织药学、医学和其他技术人员对已受理的药物临床试验申请进行审评,自受理之日起60个工作日内决定是否同意开展药物临床试验,并通过CDE网站通知申请人审批结果;逾期未通知的,视为同意,申请人可以按照提交的方案开展药物临床试验。 1689036631313497.png 新药生产上市申请(NDA) 1. 申请人在完成支持药品上市注册的药学、药理毒理学和药物临床试验等研究,确定质量标准,完成商业规模生产工艺验证,并做好接受药品注册核查检验的准备后,向药品审评中心提出药品上市许可申请,按照申报资料要求提交相关研究资料。 2. 药品审评中心对申报资料进行形式审查,符合要求的,出具受理通知书;不符合要求的,出具不予受理通知书或者申请材料补正通知书,并说明理由。 3. 药品审评中心组织药学、医学和其他技术人员,在规定时限内对已受理的药品上市许可申请进行审评。 4. 审评过程中基于风险启动药品注册核查、检验,相关技术机构应当在规定时限内完成核查、检验工作。 5. 药品审评中心根据药品注册申报资料、核查结果、检验结果等,对药品的安全性、有效性和质量可控性等进行审查,综合审评结论通过的,批准药品上市,发给药品注册证书。不予批准,发给《药品上市许可不予批准通知书》。 1689036655593381.png |
» 猜你喜欢
 中药材标准目录大全llp2026(含各省市中药材和炮制规范)
已经有2人回复
中药材标准目录大全llp2026(含各省市中药材和炮制规范)
已经有2人回复
 酰胺脱乙酰基
已经有13人回复
酰胺脱乙酰基
已经有13人回复
 药物学论文润色/翻译怎么收费?
已经有247人回复
药物学论文润色/翻译怎么收费?
已经有247人回复
 见刊快的中文核心期刊
已经有2人回复
见刊快的中文核心期刊
已经有2人回复
 一志愿天中医中药学专硕,希望有b区的老师可以考虑一下我
已经有0人回复
一志愿天中医中药学专硕,希望有b区的老师可以考虑一下我
已经有0人回复
 调剂
已经有2人回复
调剂
已经有2人回复
 药学学硕326求调剂
已经有0人回复
药学学硕326求调剂
已经有0人回复
 26年博士申请
已经有20人回复
26年博士申请
已经有20人回复
 药理学、临床药学方向 调剂
已经有0人回复
药理学、临床药学方向 调剂
已经有0人回复
 求助 苯磷硫胺JP
已经有0人回复
求助 苯磷硫胺JP
已经有0人回复
 100金币 阿莫西林克拉维酸钾片BP药典中提到的克拉维酸聚合物具体结构式是啥?
已经有1人回复
100金币 阿莫西林克拉维酸钾片BP药典中提到的克拉维酸聚合物具体结构式是啥?
已经有1人回复
» 本主题相关商家推荐: (我也要在这里推广)
|
1. 准备申请资料:首先,申请人需要准备必要的申请资料,包括产品的详细说明、质量和安全性评估文件、企业的生产许可证等证明文件。 2. 申请提交:将准备好的申请资料提交到当地的药品监管部门,如国家药品监督管理局或省级、市级的药品监管机构等。如果申请资料不齐全或不符合相关要求,可能需要修改或补充。 3. 审核和评估:药品监管部门将对申请材料进行审核和评估,评估过程中包括产品的质量、性能、安全性等方面的评估,确认产品是否符合国家相关标准和法规。如果申请材料符合要求,药品监管部门会对企业进行现场审核或抽样检验。 4. 颁发注册证:如果审核和评估都通过,当地药品监管部门将颁发医疗器械产品注册证,并将该证书的相关信息在其官方网站上公布。 需要注意的是,医疗器械产品注册证的申请时间、审核标准和申请流程可能因不同国家和地区的要求而有所不同,企业在进行注册证申请前,需要认真了解相关标准和要求,并与当地的药品监管部门联系,咨询具体申请流程和注意事项。此外,企业在申请注册证之后,还需要加强对产品的质量管理和安全监测,确保产品符合国家相关标准和法规。 |
3楼2023-07-20 16:02:58
Dr_5GH
新虫 (初入文坛)
- 应助: 0 (幼儿园)
- 金币: 361.3
- 帖子: 6
- 在线: 28分钟
- 虫号: 6993310
- 注册: 2017-07-26
- 性别: GG
- 专业: 凝聚态物性 II :电子结构
2楼2023-07-19 07:53:10














 回复此楼
回复此楼