【资源】关于粉体材料比表面的分析方法
比表面是比表面积的简称。根据实际需要,比表面积分为内比表面积、外比表面积、和总比表面积;通常未注明情况下粉体的比表面积是指单位质量粉体颗粒外部表面积和内部孔结构的表面积之和,单位m2/g。
测试方法分类
比表面积测试方法有两种分类标准。一是根据测定样品吸附气体量多少方法的不同,可分为:连续流动法、容量法及重量法(重量法现在基本上很少采用);另一种是根据计算比表面积理论方法不同可分为:直接对比法比表面积分析测定、Langmuir法比表面积分析测定和BET法比表面积分析测定等。同时这两种分类标准又有着一定的联系,直接对比法只能采用连续流动法来测定吸附气体量的多少,而BET法既可以采用连续流动法,也可以采用容量法来测定吸附气体量。
连续流动法
连续流动法是相对于静态法而言,整个测试过程是在常压下进行,吸附剂是在处于连续流动的状态下被吸附。连续流动法是在气相色谱原理的基础上发展而来,由热导检测器来测定样品吸附气体量的多少。连续动态氮吸附是以氮气为吸附气,以氦气或氢气为载气,两种气体按一定比例混合,使氮气达到指定的相对压力,流经样品颗粒表面。当样品管置于液氮环境下时,粉体材料对混合气中的氮气发生物理吸附,而载气不会被吸附,造成混合气体成分比例变化,从而导致热导系数变化,这时就能从热导检测器中检测到信号电压,即出现吸附峰。吸附饱和后让样品重新回到室温,被吸附的氮气就会脱附出来,形成与吸附峰相反的脱附峰。吸附峰或脱附峰的面积大小正比于样品表面吸附的氮气量的多少,可通过定量气体来标定峰面积所代表的氮气量。通过测定一系列氮气分压P/P0下样品吸附氮气量,可绘制出氮等温吸附或脱附曲线,进而求出比表面积。通常利用脱附峰来计算比表面积。
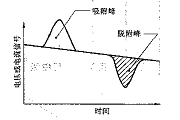
特点:连续流动法测试过程操作简单,消除系统误差能力强,同时具有可采用直接对比法和BET方法进行比表面积理论计算。
容量法
容量法中,测定样品吸附气体量多少是利用气态方程来计算。在预抽真空的密闭系统中导入一定量的吸附气体,通过测定出样品吸脱附导致的密闭系统中气体压力变化,利用气态方程P*V/T=nR换算出被吸附气体摩尔数变化。
直接对比法
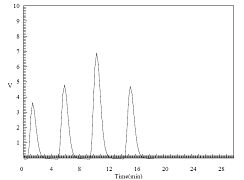
直接对比法比表面积分析测试是利用连续流动法来测定吸附气体量,测定过程中需要选用标准样品(经严格标定比表面积的稳定物质)。并联到与被测样品完全相同的测试气路中,通过与被测样品同时进行吸附,分别进行脱附,测定出各自的脱附峰。在相同的吸附和脱附条件下,被测样品和标准样品的比表面积正比于其峰面积大小。
计算公式如下: 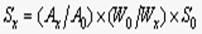
Sx:被测样品比表面积 S0:标准样品比表面积,
Ax:被测样品脱附峰面积 A0:标准样品脱附峰面积
Wx:被测样品质量 W0:标准样品质量
优点:无需实际标定吸附氮气量体积和进行复杂的理论计算即可求得比表面积;测试操作简单,测试速度快,效率高
缺点:当标样和被测样品的表面吸附特性相差很大时,如吸附层数不同,测试结果误差会较大。
直接对比法仅适用于与标准样品吸附特性相接近的样品测量,由于BET法具有更可靠的理论依据,目前国内外更普遍认可BET法比表面积测定。
BET比表面积测定法
BET理论计算是建立在Brunauer、Emmett和Teller三人从经典统计理论推导出的多分子层吸附公式基础上,即著名的BET方程:
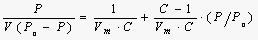
P: 吸附质分压 P0: 吸附剂饱和蒸汽压
V: 样品实际吸附量 Vm: 单层饱和吸附量
C:与样品吸附能力相关的常数
由上式可以看出,BET方程建立了单层饱和吸附量Vm与多层吸附量V之间的数量关系,为比表面积测定提供了很好的理论基础。
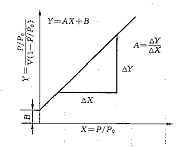
BET方程是建立在多层吸附的理论基础之上,与许多物质的实际吸附过程更接近,因此测试结果可靠性更高。实际测试过程中,通常实测3-5组被测样品在不同气体分压下多层吸附量V,以P/P0为X轴, 为Y轴,由BET方程做图进行线性拟合,得到直线的斜率和截距,从而求得Vm值计算出被测样品比表面积。理论和实践表明,当P/P0取点在0.05-0.35范围内时,BET方程与实际吸附过程相吻合,图形线性也很好,因此实际测试过程中选点需在此范围内。由于选取了3-5组P/P0进行测定,通常我们称之为多点BET。当被测样品的吸附能力很强,即C值很大时,直线的截距接近于零,可近似认为直线通过原点,此时可只测定一组P/P0数据与原点相连求出比表面积,我们称之为单点BET。与多点BET相比,单点BET结果误差会大一些。
若采用流动法来进行BET测定,测量系统需具备能精确调节气体分压P/P0的装置,以实现不同P/P0下吸附量测定。对于每一点P/P0下BET吸脱附过程与直接对比法相近似,不同的是BET法需标定样品实际吸附气体量的体积大小,而直接对比法则不需要。
特点:BET理论与物质实际吸附过程更接近,可测定样品范围广,测试结果准确性和可信度高,特别适合科研及生产单位使用。
[ Last edited by hsqlxsz on 2010-12-3 at 17:26 ]![]() 返回小木虫查看更多
返回小木虫查看更多



 京公网安备 11010802022153号
京公网安备 11010802022153号
再补充一点点。
粉体材料的颗粒很细,颗粒形状及表面形貌错综复杂,因此直接测量它的表面积是不可能的,只能采用间接的方法,多年来已提出了多种测量方法,其中氮物理吸附法被公认为是最成熟的方法,已被列入世界各国的标准,实践中被广泛采用。
氮吸附法是依据气体在固体表面的吸附规律,例如,在液氮温度下(-196℃),在一定的氮气压力下,任何粉体材料的表面都可以吸附氮气的分子,并对应于确定的平衡吸附量,这种吸附是纯粹的物理吸附,即被吸附的气体分子与固体表面的结合力很弱,而且是可逆的,即在回到室温的过程中,所有被吸附的氮分子又都被脱附出来。
假定,在粉体颗粒的表面完全吸附满一层氮分子,那么粉体的比表面积(Sg)可用吸附的氮分子数和每个分子所占的面积求出:
…… Sg = Vm•N•Am / 22400•W ……………………………… (1)
式中: Vm: 氮气的单分子层饱和吸附量(ml)
Am: 氮分子横截面积 ( Am = 0.162nm2 )
W: 粉体样品的重量(g)
N: 阿佛加德罗常数
把上述具体数据代入式(1),得到氮吸附法计算比表面积的基本公式:
Sg = 4.36Vm / W ……………………………………… (2)
由此可见,准确测定被测样品表面单层饱和吸附量Vm是比表面积测定的关键。
没人看啊,我晕。好吧,我再补充点关于朗格缪尔测试方法的一些知识。
单分子层吸附与朗穆尔方程
如果在固体表面上吸附的气体仅仅只有一分子的厚度,则称作单分子层吸附。如果吸附层厚度超过一分子,则称多分子层吸附。在多分子层吸附中的第一分子层也常常称为单分子层。
郎穆尔早在1916年(1)就导出了单分子层吸附的状态方称,后人称之为郎穆尔单分子层吸附方称。可以有两条途径推导得郎穆尔方程。一条是动力学的途径,在吸附平衡时吸附速度与脱附适当相等,吸附的速度与气相的压力成正比,而脱附速度则与已吸附的表面占总表面的百分数称正比,由此变可得郎穆尔方程。有动力学的方法推导郎穆尔方程容易给人以假像,好像方程的得来与吸附及脱附机理有关,其实则不然。一条是统计热力学的途径,因为吸附方称是一个气体在固体表面的状态方程,是反应平衡态的,所以,总可以由统计热力学导出。有了前一节冠以热力学与统计热力学的知识准备后,用统计热力学推导郎穆尔方程是很容易的。用统计热力学的方法推导郎穆尔方程比用动力学的方法似乎稍复杂一点,但这条途径的好处在于对吸附状态的了解更为细致,方程中出现的常数有明确的物理意义(2),而且,用的是统计热力学的一般方法,通过郎穆尔方程的推导,掌握这种方法本身也是很重要的。
设固体的表面积平均来说均匀的,每平方厘米上有NOO个吸附中心,每个吸附中心可以是空着的,或吸附了一个分子,如图3.2所示。若每平方厘米上吸附了N个分子,每个分子的配分函数为qa(T),按前面的式(3.40)则N个吸附分子的总的配分函数为
图3.2单分子层吸附
Q=___ NOO!____ qNa(T) (3.45)
N!(NOO-N)!
式中含有阶乘的因子即Q的出现体现了N个分子在NOOGE XF 中心上的排列方式,由于吸附中心和气体分子本身都是不可区别的,所以,吸附了分子的吸附中心和未吸附分子的吸附中心各自本身之间的重新排列并不产生新的排列方式,要从总的NOOGE 吸附中心的排列方式NOO!中扣除。
将前面的斯特林公式(3.20)用于式(3.45),得到
1Nq=NOO1nNOO-N1Nn-(NOO-N)1n(NOO-N)+N1nqa(T)
因而由式(3.41)知表面吸附相气体分子的化学势为
μa=-RT{(ò1nQ)/(òN)}NOOT=RT1n___θ___×___1___ ( 3.46)
1-θ qa(T)
其中θ≡N/NOO,称为表面覆盖度。
由前面一节知,气相气体分子的化学势为
μg=μ0g(T)+RT1nÞ
吸附平衡时,气相气体分子的化学势μg应与吸附相气体分子的化学势μa相等,所以
__θ__×___1___=(exp×__μgo(T)__)×Þ
1-θ qa(T) RT
将qa(T)与exÞ__μgo(T)__合并成一个常数b(T)≡qa(T)exÞ×__μgo(T)__,
RT RT
并且重排上式得
θ= bÞ
1+bÞ
(3.47)
此即郎穆尔单分子层吸附方程。
若以Γ与V表示单位固体表面上的吸附的气体的量与体积,而Γm与Vm各表示单位固体表面上饱和吸附的气体的量与体积,则郎穆尔方程还可以写成另外两种常用的形式
Γ= Γm bÞ 与V=Vm bÞ (3.48)
1+bÞ 1+bÞ
一般说来,在吸附质气体的临界温度以上时,在非反应的固体表面上常常发生单分子层吸附。发生单分子层吸附时,吸附等温线有图3.3的形状;在压力甚低时式(3.47)中分母中
图3.3 单分子层吸附等温线
的相对于1可以忽略不计,θ与压力Þ成正比;在压力甚高时式(3.47)分母中的1相对于bÞ可以忽略,θ达到饱和值1,即发生了饱和和吸附。
式(3.47)及(3.48)还可以写成直线形式
_1_=__1__+__1___×_1_
Γ Γm Γmb Þ (3.49)
为了检测吸附是否具有单分子层的性质,或为了求出常数b及Γm,用式(3.49)是很方便的。作 1 - 1 图,从直线的截距便可求出饱和和吸附量Γm或饱
Γ Þ
和吸附体积Vm;从直线的斜率可求出b(T).由式(3.44)知。
μgo(T) μgo(T) εa
b(T)≡qa(T)exÞ =qao(T)exÞ ×exÞ( )
RT RT RT
得 εa
b(T)=b0(T)exÞ( )
RT
εa
B0(T)是一个温度T的多项式,它与exÞ( )比较起来,对温度的依赖性可忽略 RT
不计。εa为吸附分子基态的能量。若是定气体分子基态的能量为零,则εa即为一个分子的吸附热,因此,求出不同温度下的b(T),从1nb(T)- 1 图示的斜率便可求得吸附热
T
εa。这里采用热力学符号标准,吸附为正,放热为负,这样,放热时εa为负值。
虽然单分子层吸附等温线具有式(3.47)所描述的形式,但是,反过来,吸附等温线具有式(3.47)描述的性质的却不一定是单分子层吸附。很多只含20-30A(0)以下微孔的吸附剂,虽然发生的是单分子层吸附,其吸附等温线也往往有式(3.47)描述的形式,
难道就是这么没有价值的帖子?伤心了
顶下,好贴子,就是不怎么懂!
顶 楼主,这东西挺抽象的 啊,我一般做固液界面的吸附,而且是异质的,看了很多文献 没有介绍具体原理,只是借用langmuir气体方程
如果有pdf或者word版本的就更好了,因为有写乱码,哈哈
这个发到催化版
顶的人肯定多