【讨论】电子结构能量E与自由能G,如何判断化学反应走向
从头算得的能量一般是电子与原子核以及电子与电子相关的能量,这部分能量叫做E,。
然而试验中,判断化学反应是否平衡的时候呢,一般用自由能的变化,deltG大于,等于,或小于,来判断反应朝哪个方向进行。。
对于一个分子来说呢,G=H-TS,其中,这个H包含了分子中电子的能量E, 分子平动,转动,振动, 未成对电子的运动的能量,还有KbT,(Kb是波尔兹曼常数)。S中也包含了分子平动,转动,振动, 未成对电子的运动的贡献。
问题是,我们在讨论化学反应的时候,尤其是从诸多基元反应中选取可能的反应途径的时候,是应该以E为标准呢?还是应该以自由能的变化为标准呢?
请大家讨论!
有金币伺候。。哈哈![]() 返回小木虫查看更多
返回小木虫查看更多
今日热帖



 京公网安备 11010802022153号
京公网安备 11010802022153号
理论上应该是以G的变化
为什么呢?G是来判断动态的平衡。
比如在诸多基元反应中,你要挑选一个可能的途径的话,都不知道每种组分的分压,而且基元反应不是在动态平衡的系统中进行的。
关于3楼:反应能向前也能向后 但是有时候产物的绝对G比反应物的小太多,生成产物后就不能回去了 这就造成了宏观上的生成产物。
如果两者G相差不太多 而且barrier不是很难克服 就会造成反应物产物的稳定共同存在
关于1楼:如果能算G当然用G,这个考虑了对外做功等因素。像H的话只是考虑了能量,只是比E更贴近实际一点。
当然是用G,因为它包含了温度和熵的影响。由G=H-TS可知,提高反应的温度在热力学上并不总是有利的,只有当S>0时才会提高反应进行的程度。而提高温度总伴随着反应速率的增加,即在动力学上总是有利的。因此:如果S>0,温度升高热力学上有利于反应进行,产物产率增加。而当S<0时,温度升高对反应在热力学上是不利的。合成氨工业中采用高温主要是动力学原因。
同意四楼的说法。我主要是偏物理方面的,一些问题我都是看的能量E。救我个人而言,牵扯到化学反应的 一般都要用G准确些 呵呵
在讨论反应路径的时候,过渡态理论使用的是势能面。势能面当然指的是能量。
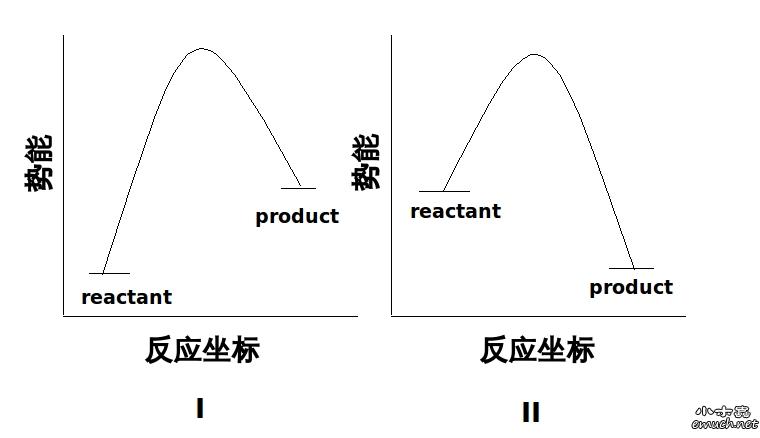
下图是势能面的剖面图。
反过来说,如果上图中纵坐标是自由能,根据反应发生的判据delta G >0 的反应是不能进行的,那么上图 I 表示的反应就不能进行,那么上图表示的不是反应路径而是反应是否能发生。可如果纵坐标表示势能,上图 I 只不过表示一个吸热反应,如果势垒不是很高的话还是可以发生的。
正如三楼所说,自由能判据是用来判断反应能否发生,势能面才是用来判断反应路径。
[ Last edited by 043114076 on 2010-10-23 at 13:03 ],
嗯有道理。两幅图的纵坐标都是能量(E或者H),但是自由能都是右面小于左面。所以右面的是Product,左面的是reactant
[ Last edited by Joannaouc on 2010-10-23 at 17:02 ]