氧化银溶解问题
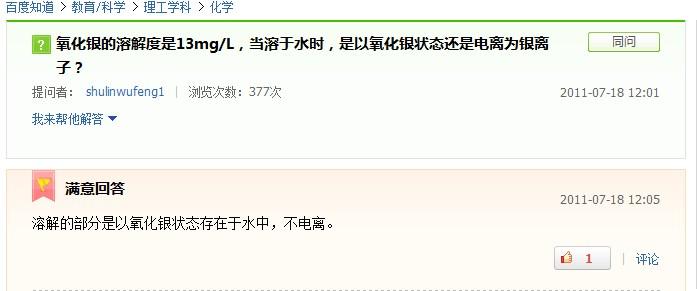
如题,前几天想要查一下氧化银的溶解度,手头又没有手册,就上网查了,没想到看到了下面的答案(图),然后就觉得对着个满意回答很怀疑,于是查了高教的无机与分析化学,仔细阅读其中沉淀与溶解平衡一章,发现书中没有提到溶解后的电解质还以原来形态存在的特例,都是溶解即电离,而且溶解过程说的很清楚,固体表面的阴阳离子受到极性水分子的作用,不断进入溶液中,而这些离子作无规则运动,又可能会回到固体表面。这两者建立平衡,即为沉淀溶解平衡。
如果氧化银是个特例,溶解掉的还是氧化银分子,那么就不会有氧化银呈碱性的说法了吧?这当中还是有些迷惑,还望高手指点
GZA0DC(HL8~44N8X%]J1U$5.jpg![]() 返回小木虫查看更多
返回小木虫查看更多
今日热帖



 京公网安备 11010802022153号
京公网安备 11010802022153号
百度上回答问题,瞎扯的不少,所以不必当真。
首先并不是所有电解质溶解后都完全电离,仅当是强电解质时,溶解部分完全电离,另外还有弱电解质,其溶解部分不能保证完全电离。
对于氧化银来说,溶解时应该先与水作用,形成AgOH,再电离成Ag(+)和OH(-);由于其溶解度很小,所以溶解部分可以考虑完全电离。
如果真的显碱性,说明有OHˉ,那么肯定有部分Ag+,可知氧化银和水反应产生氢氧化银,氧化银溶入水就像CO2溶入水,部分生成碳酸,部分以CO2的形式存在。
基维百科的比较靠谱点的说
http://zh.wikipedia.org/wiki/%E6%B0%A7%E5%8C%96%E9%93%B6
氧化银在水中可略微溶解,生成 [Ag(OH)2]  ̄ 离子及类似的水解产物。
(参考出处:Cotton, F. Albert; Wilkinson, Geoffrey. Advanced Inorganic Chemistry (2nd Ed.). New York:Interscience. 1966. Advanced Inorganic Chemistry by Cotton and Wilkinson, 2nd ed. p1042)
溶解度(水)0.0013 g/100 ml (20°C)
那么它在水中溶解生成[Ag(OH)2]-的反应式是不是:
Ag2O+H2O=2AgOH
AgOH+OH-=[Ag(OH)2]-
[Ag(OH)2]-+OH-=[Ag(OH)3]-
....
中间产物氢氧化银肯定是有了,那么是不是会有单个的氧化银分子游离到水中,进而以氧化银的形式存在呢?
谢了,弱电解质部分电离,部分以分子形式存在,能不能这么理解?
1、你的理解是对的。但当弱电解质的浓度很小很小时,也可以认为完全电离,如0.1mol/LHAc有约1.3%电离,而当浓度为0.000001mol/L,那它的电离度就几乎是100%了。
2、维基百科稍微靠谱一点,但Ag2O溶于水后如果变成阴离子,那就有点问题了,理由如下:
(1)如果在纯水中存在阴离子,那一定发生了如下反应
AgOH + H2O = [Ag(OH)2](-) + H(+)
这一结果,溶液是酸性的!也就是说,AgOH是酸!Ag2O是酸性氧化物;
(2)由于Ag2O的溶解度很低,纯水中的OH(-)浓度也很低,在如此低浓度的情况下还能结合生成[Ag(OH)2](-),说明配合物[Ag(OH)2](-)超稳定!其实大家都知道,Ag(+)亲硫能力强,而亲氧能力差,可见银阴离子的存在也是违背规律的;
(3)如果真存在[Ag(OH)2](-),且那么稳定,说明氧化银在碱中的溶解度很高,可事实是氧化银不溶于碱,所以银阴离子存在也是有违事实的。
结论:[Ag(OH)2](-)的存在不靠谱
,